[01]-PRINCIPIOS FUNDAMENTALES
|
13/45 | [01][02][03][04][05] |
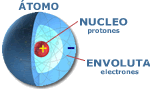 Estructura del Átomo |
EL ÁTOMO: En esencia la constitución del átomo, refiriéndonos a su aspecto
eléctrico, consta de un determinado numero de protones con carga positiva en el
núcleo y una cantidad igual de electrones, con carga negativa, girando en
diferentes órbitas del espacio, denominada envoluta. El número máximo de electrones que se pueden alojar en cada órbita es de 2n2, siendo "n" el número de órbitas. Los electrones giran en órbitas casi elípticas, en cada una de las cuales y según su proximidad al núcleo, solo pueden existir un numero máximo de electrones. Atendiendo a la carga eléctrica como inicialmente mencionábamos, los átomos, se pueden clasificar en positivos, negativos y neutros. Los átomos de elementos simples, cuando están completas sus órbitas son neutros, hay igual cantidad de electrones que de protones; pero dado que los electrones de la última órbita son los más alejados del núcleo y por tanto, perciben menos su fuerza de atracción, pueden salirse de dicha órbita denominada de valencia, dejando al átomo cargado positivamente por contener más protones que electrones, si por el contrario en el último orbital del átomo hubiese alojado un electrón libre exterior al átomo habría adquirido carga negativa, a estas dos situaciones se les denomina iones. ÁTOMOS ESTABLES E INESTABLES: Se llama átomo estable al que tiene completa de electrones su última órbita o al menos dispone en ella de ocho electrones. Los átomos inestables, que son los que no tienen llena su órbita de valencia ni tampoco ocho electrones en ella, tienen una gran propensión a convertirse en estables, bien desprendiéndose de los electrones de valencia o bien absorbiendo del exterior electrones libres hasta completar la última órbita; en cada caso realizaran lo que menos energía suponga. CUERPOS CONDUCTORES Y AISLANTES: Los cuerpos conductores son aquellos cuyos átomos permiten fácilmente el paso de electrones a su través. Un buen ejemplo de conductor es el Cobre (Cu) que dispone de un electrón inestable en su cuarta órbita con una gran tendencia a desprenderse. CUERPOS SEMICONDUCTORES INTRINSECOS: Mientras que los cuerpos buenos conductores ofrecen escasa resistencia al paso de electrones, los aislantes la ofrecen elevadísima, y entre ambos extremos, se encuentran los semiconductores que presentan una resistencia intermedia. Un ejemplo de elemento semiconductor es el Silicio (Si), la característica fundamental de los cuerpos semiconductores es la de poseer cuatro electrones en su órbita de valencia. Con esta estructura el átomo es inestable, pero para hacerse estable se le presenta un dilema: y es que le cuesta lo mismo desprenderse de cuatro electrones y quedarse sin una órbita, que absorber otros cuatro electrones para hacerse estable al pasara tener ocho electrones. En estas especiales circunstancias, ciertos elementos como el Silicio y el Germanio (Ge) agrupan sus átomos de manera muy particular, formando una estructura reticular en la que cada átomo queda rodeado por otros cuatro iguales, propiciando la formación de los llamados enlaces covalentes. En estas circunstancias, la estructura de los cuerpos semiconductores, al estabilizarse, debería trabajar como buen aislante, pero no es así a causa de la temperatura. Canto mayor es la temperatura aumenta la agitación de los electrones y por consiguiente enlaces covalentes rotos, dando lugar a electrones libres y huecos (falta de electrón). SEMICONDUCTORES EXTRÍNSECOS: Comoquiera que las corrientes que se producen en el seno de un semiconductor intrínseco a la temperara ambiente son insignificantes, dado el bajo valor de portadores libres, para aumentarlos se les añaden otro cuerpos, que se denominan impurezas. De esta forma es como se obtienen los semiconductores extrínsecos tan importantes en la energía solar fotovoltaica. |
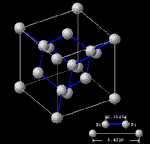 Estructura Cristalina del Si Cortesía de wie@acsu.buffalo.edu (c) Copyright C.R.Wie 1997-1998. | |
Vista en 3D de la estructura cristalina del Si, Ge, AsGa, etc... Cortesía de wie@acsu.buffalo.edu (c) Copyright C.R.Wie 1997-1998. | |
|
|